SpyDisplay|集成SpyTag/SpyCatcher技术的多功能噬菌体展示筛选系统
引言
SpyCatcher-SpyTag (SpyC/SpyT)系统是从化脓链球菌(Streptococcus pyogenes)纤连蛋白结合蛋白(fibronectin binding protein)的CnaB2结构域改造而来的。SpyC是分子量约为12 kDa的免疫球蛋白样蛋白,SpyT是由13 个残基组成的短肽,二者能够高亲和力地彼此识别并自发形成异肽键,即SpyC中反应性赖氨酸的伯氨基与SpyT中天冬氨酸的羧基通过脱水形成的酰胺键。
作为快速、可靠、不可逆的肽-蛋白质偶联工具,SpyC/SpyT系统除被应用于药物递送、疫苗研发以外,在噬菌体展示筛选系统中也体现出重要的应用价值。如2019年,Fierle等人利用SpyC/SpyT系统优化抗原的表达和锚定。他们发现SpyC可作为融合标签蛋白在大肠杆菌/真核细胞中分泌表达细胞表面抗原,且保留SpyC和抗原各自的功能。利用磁珠上包被的SpyT短肽可以直接从培养上清液中高效且特异性地捕获SpyC融合抗原,省去了抗原纯化等环节,且这种共价锚定的抗原能够经受严格的洗涤条件并稳健地从噬菌体展示文库中分离出高亲和力的功能性的单链抗体[1]。近期,Kellmann等人将SpyC/SpyT系统用于噬菌体展示文库的构建,发表了题为“SpyDisplay: A Versatile Phage Display Selection System using SpyTag/SpyCatcher Technology”的文章,他们通过将SpyC-pIII和Fab-SpyT共表达以产生Fab的SpyDisplay噬菌体文库[2]。
SpyDisplay噬菌体展示文库的概念
利用SpyC和SpyT共价偶联的特点(图1A),将“SpyC-TEV site-pIII”基因和“Fab-SpyT”基因在大肠杆菌中共表达,这两种融合蛋白在大肠杆菌细胞内发生共价偶联并形成“pIII-TEV site-SpyC-SpyT-Fab”融合蛋白,诱导噬菌体组装后,Fab抗体最终展示在噬菌体表面(图1B)。

实验设计和分析
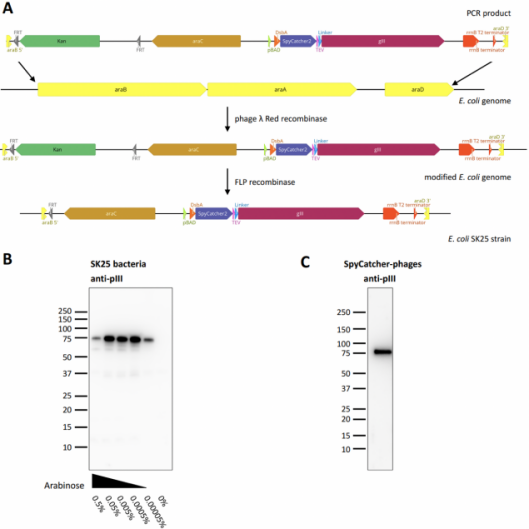
1、创建能够表达SpyCatcher-pIII蛋白并生产SpyCatcher展示噬菌体的大肠杆菌SK25菌株
将“Kan-SpyCatcher-TEV site-pIII”表达框替换TG1大肠杆菌基因组中阿拉伯糖(arabinose)代谢所需的内源性araBAD基因,继而去除卡那霉素基因得到SK25大肠杆菌菌株(图2A),新创建的SK25菌株能够在补充阿拉伯糖的情况下诱导表达SpyCatcher-pIII蛋白(图2B),进而在Hyperphage辅助噬菌体(一种缺乏pIII的辅助噬菌体,可增加每个噬菌体颗粒展示的抗体数量)感染后产生多价的SpyCather噬菌体(图2C)。
2
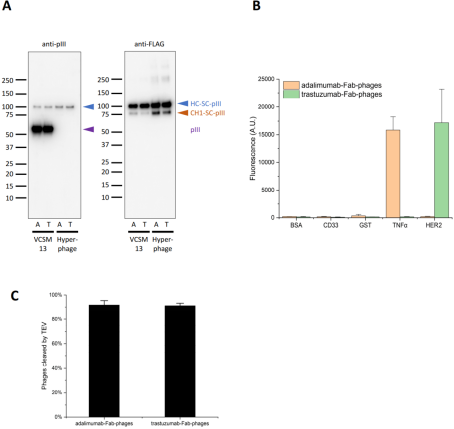
利用SK25菌株生产Fab抗体的SpyCatcher噬菌体展示文库
将FLAG-SpyTag2-His6连接到Fab重链的C末端并克隆到包含乳糖操作子的pBBx2-F-Spy2-H噬菌体载体中,将文库噬菌体作为表达质粒转化大肠杆菌SK25菌株,加入阿拉伯糖和IPTG(一种乳糖类似物)分别诱导SpyC和SpyT融合蛋白的表达,随后利用VCSM13和或Hyperphage辅助噬菌体感染分别产生单价Fab和多价Fab SpyCatcher噬菌体展示文库。尽管多价噬菌体文库的病毒滴度较单价噬菌体低三个数量级(图A),但它能够有效并特异性地与抗原结合(图B),捕获在抗原上的噬菌体可通过向体系中加入TEV蛋白酶而有效地被洗脱下来(图C)。pIII的N末端融合会降低噬菌体的感染性,导致多价噬菌体的滴度低,野生型pIII能够更快地组装到噬菌体外壳导致单价噬菌体的Fab-pIII在总pIII中的占比较低。
3、基于SpyTag/SpyCatcher的Fab噬菌体组装发生在胞质内
SpyDisplay与传统抗体噬菌体展示的一个关键区别是抗体和衣壳蛋白单独折叠,这可能有利于展示正确折叠的抗体。但若要保证噬菌体的基因型和表型一致,就要求SpyCatcher-pIII与SpyTagged Fab的偶联必须在细菌胞质发生,若展示游离SpyCatcher-pIII的噬菌体分泌到上清中,就有可能与其他细菌释放的Fab偶联,并导致噬菌体展示的抗体与自身编码的抗体不一致。
作者设计了两组实验,实验组:先将分别表达曲妥珠单抗和阿达木单抗的SK25大肠杆菌培养物按比例混合,随后加入VCSM13辅助噬菌体,过夜培养以产生Fab噬菌体。对照组:分别产生曲妥珠单抗Fab-phages和阿达木单抗Fab-phages,并使用SpyTag3肽去饱和潜在的空闲SpyCatcher位点,最后将两种Fab-phages按照实验组使用的比例混合。两组样品分别进行淘选并最终各挑取95 个单克隆进行测序,发现曲妥珠单抗在实验组/对照组中的阳性率为100%/99%,阿达木单抗为96%/100%,而少量的阴性克隆(实验组与对照组相似)则是由噬菌体的非特异性引起的,结果表明Fab与SpyCatcher-pIII的结合发生在细菌胞质内。
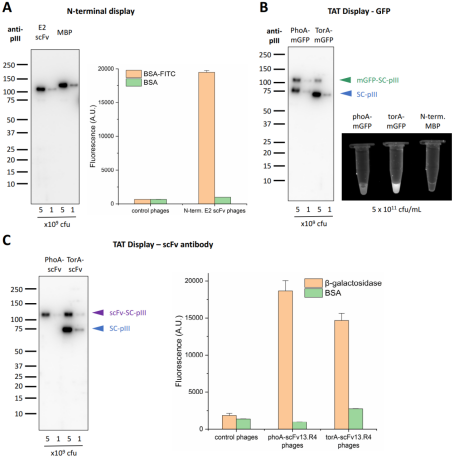
4、SpyDisplay可实现N端展示和通过TAT途径介导的展示
N端展示即裸露蛋白的C端,可通过构建“SpyT-展示蛋白”实现。以SpyT-MBP和SpyT-scFV为例,如图A所示,SpyDisplay实现了良好的N端展示率,且N端展示的scFV具备靶标特异性的结合能力,表明其正确折叠。
SpyDisplay的另一优势是展示细胞质中折叠的蛋白。一般分泌途径(general secretory pathway,Sec)和双精氨酸转运(twin-arginine translocation,TAT)途径是大肠杆菌将重组蛋白转运到周质空间的主要途径,前者当蛋白质在细胞质中翻译后缓慢折叠或不折叠后转运至周质空间,后者当蛋白质在细胞质完成折叠后才开始转运,二者分别具有PorA和TorA信号肽序列。以单体绿色荧光蛋白(mGFP,仅在胞质中折叠成熟后才能产生荧光)和scFv13.R4(可以在细胞质或周质空间中折叠的抗β-半乳糖苷酶的抗体)为例,如图B和图C所示,TAT途径介导的mGFP以及scFv13.R4的多价SpyDisplay噬菌体均具有功能活性,表明SpyDisplay可实现TAT途径介导的胞质折叠蛋白的展示。
与Sec途径相比,TAT途径的展示率较低,可能与噬菌体生产过程中两种途径本身的转运效率相关。
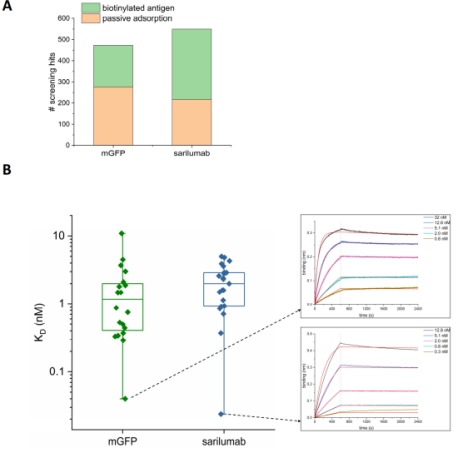
5、从Fab SpyDisplay文库中筛选抗体
为了测试SpyDisplay筛选高亲和力抗体的效率,对mGFP和sarilumab(一种靶向IL-6受体的抗体)的抗体决定簇分别进行被动吸附固定和生物素-链霉亲和素固定,随后进行三轮筛选。各取50个克隆进行测序,发现mGFP产生了68%的特异性抗体,sarilumab产生了46%的特异性抗体。
通过生物膜干涉技术(BLI)检测生物素化固定的这两种蛋白与筛选得到的抗体之间的结合和解离动力学。如图B所示,在所有测量的抗体中,KD值普遍低于10 nM。mGFP和sarilumab抗体决定簇与其最佳抗体的亲和分别为40 pM和24 pM,证明SpyDisplay适合于筛选高亲和力的抗体。
结语
除SpyTag/SpyCatcher系统外,其他蛋白质连接技术如SnoopTag/SnoopCatcher DogTag/DogCatcher也可用于建立类似的“共价捕获”的展示方法。
利用SpyTag/SpyCatcher系统建立的SpyDisplay能够实现N端展示和通过TAT途径介导的展示,适用于筛选高亲和力的抗体,优化的实验方案允许在一天内进行一轮筛选而无需对输出物进行铺板,在高通量抗体筛选方面同样具有优势。此外,SpyDisplay并不局限于展示抗体,也适用于展示其他包含SpyTag标记并且可以运输到胞质的蛋白。SpyDisplay也不局限于大肠杆菌宿主的噬菌体展示,但强调载体和宿主表达体系之间的兼容性。
参考文献:1. Fierle, J.K., et al., Integrating SpyCatcher/SpyTag covalent fusion technology into phage display workflows for rapid antibody discovery. Sci Rep, 2019. 9(1): p. 12815.2. Kellmann, S.J., et al., SpyDisplay: A versatile phage display selection system using SpyTag/SpyCatcher technology. MAbs, 2023. 15(1): p. 2177978.





